Mivel az Apple a hírek szerint az iWatch-el megy a piacra, az FDA-val is találkoznak, támogatva az iWatch fejlett orvosi potenciáljáról szóló pletykákat.
Az Apple iWatch-je, amely jelenleg az iparági pletykák és a fogyasztói kíváncsiság tárgya, készen áll az egészségügyi ágazat átalakítására. Szakértők azt feltételezik, hogy az iWatch képes lesz az orvosi adatok széles skáláját nyújtani mindenki számára a csúcsteljesítmény iránt érdeklődő futóktól a sürgősségi osztályok személyzetéig, akiknek gyors statisztikákra van szükségük a kezeléshez betegek. A pulzus- és hidratációs statisztikáktól a cukorbetegek glükózszintjéig az iWatch az iparág innovációját ígéri.
Úgy tűnik, az Apple nagyon jól megérti, hogy az iWatch orvosi technológiájának piacra jutásának legnagyobb akadálya az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatósága (FDA) lehet. Az FDA a mobilalkalmazásokat/eszközöket „okostelefonokon és egyéb mobilkommunikációs eszközökön futó szoftverprogramokként határozza meg. Lehetnek olyan kiegészítők is, amelyek okostelefonhoz vagy más mobil kommunikációs eszközhöz kapcsolódnak, vagy kiegészítők és szoftverek kombinációja.” (7) Mert Az iWatch orvosi technológia potenciálisan kockázatot jelenthet azokra az emberekre, akik esetleg használják, ezért előfordulhat, hogy az FDA-nak felül kell vizsgálnia minden iWatch orvosi alkalmazást, mielőtt dob.
Tartalom
- Kapcsolatok ápolása
-
A várakozó játék
- Kapcsolódó hozzászólások:
Kapcsolatok ápolása
Valószínű, hogy az Apple egy ideje figyeli ezt az akadályt. Valójában az Apple vezetői nem sokkal az első iPad 2010. áprilisi piacra dobása óta találkoznak az FDA illetékeseivel.
Az Apple vezetői tudták, hogy az iPadben óriási lehetőségek rejlenek az orvosi iparban. Attól a pillanattól kezdve, hogy az iPad elindult, az egészségügyi szakemberek magukévá tették az iPadet, és 2010 júliusára több mint 2000 orvosi alkalmazás töltötte be az Apple App Store-t. (3)
Ahogy az iPadben az orvosi ipar szereplőjeként rejlő lehetőségek nőttek, az Apple kapcsolatot ápolt az FDA-val. Az FDA nyilvános nyilvántartása szerint az Apple és az FDA háromszor találkozott, először 2010. április 8-án. „orvosi alkalmazásokról” (5), majd 2010. június 11-én ismét az „orvosi eszközök” témában. (6)

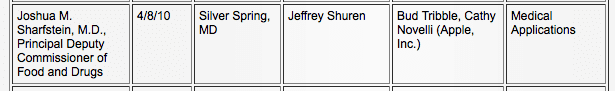
Az FDA feladata, hogy egyensúlyt teremtsen a közbiztonság és a közérdek között. E két találkozó után, 2011 júliusában az FDA kiadta a mobil orvosi alkalmazások definícióinak és irányelveinek első iterációját. (8) 2011 szeptemberére az Apple elindította az „Alkalmazások egészségügyi szakembereknek” elnevezésű részt az App Store-jában (4), amely egészségügyi témájú. referencia- és oktatási alkalmazások, valamint fejlettebb alkalmazások, beleértve az elektronikus egészségügyi feljegyzéseket (EMR), a betegek megfigyelését és képalkotás.
A várakozó játék
Az Apple vezetői 2013 decemberében visszatértek az FDA-ba, hogy megvitassák a „mobil orvosi alkalmazásokat”, ami egyértelmű jelzés hogy az Apple eléggé belépett az egészségügyi monitorozás technológiai arénájába ahhoz, hogy tudja, beszélnie kell az FDA-val a címen hossz.

Az FDA finomította az orvosi alkalmazásokkal és eszközökkel kapcsolatos definícióit és irányelveit. „Egyes mobilalkalmazások minimális kockázatot jelentenek a fogyasztókra vagy betegekre nézve, mások azonban jelentős kockázatot hordozhatnak, ha nem működnek helyesen” – áll az FDA legutóbbi sajtóközleményében, hozzátéve: „Az FDA személyre szabott politikája védi a betegeket, miközben bátorítja innováció." (2)
A sajtóközlemény így folytatódott:
Az FDA felügyeletét azokra a mobil orvosi alkalmazásokra összpontosítja, amelyek:
- szabályozott orvostechnikai eszköz tartozékaként használhatók – például olyan alkalmazás, amely lehetővé teszi az egészségügyi szakember számára, hogy konkrét diagnózis felállítása egy képarchiváló és kommunikációs rendszerből (PACS) származó orvosi kép megtekintésével okostelefonon vagy mobiltelefonon tabletta; vagy
- átalakítja a mobil platformot szabályozott orvosi eszközzé – például olyan alkalmazássá, amely az okostelefont egy elektrokardiográfia (EKG) készülék a kóros szívritmus kimutatására, vagy annak megállapítására, hogy a beteg szívrohamot szenved-e. (2)
Bizonyos funkciók, amelyekre az iWatch a pletykák szerint törekszik, természetesen az FDA felügyelete alá tartozik. az orvosi mobileszközökre és -alkalmazásokra vonatkozó irányelveket, amelyek az Apple-t ugyanolyan FDA-vizsgálatnak vetik alá, mint a többit gyártók.
Hogyan hatnak az FDA szabályozásai, felülvizsgálatai, jóváhagyásai és folyamatai az Apple iWatch orvosi verziójának kiadására? Vegyük a Smart Body Analyzer esetét, a Withings termékét, amely méri a súlyt, a testzsírszázalékot és a pulzusszámot, és szinkronizálja az okostelefonokkal és iPadekkel. Withings csaknem három évet várt, hogy megkapja az FDA engedélyt az induláshoz.(1) Az Apple kifinomultabb funkcionalitása hosszabb időt jelenthet az FDA jóváhagyási ideje, de talán az FDA-val való találkozással a fejlesztési szakaszban az Apple vásárolt egy kis időt piac.

Az A/UX Apple-re való korai megjelenése óta a technológia megszállottja, Sudz (SK) felelős az AppleToolBox szerkesztői irányításáért. Székhelye Los Angeles, CA.
A Sudz a macOS-re szakosodott, mivel az évek során több tucat OS X és macOS fejlesztést tekintett át.
Korábbi életében Sudz segítette a Fortune 100-as cégeket technológiai és üzleti átalakítási törekvéseik megvalósításában.