Pranešama, kad „Apple“ eina į rinką su „iWatch“, jie taip pat susitinka su FDA, palaikydami gandus apie pažangų „iWatch“ medicininį potencialą.
Apple iWatch, šiuo metu apie pramonės gandus ir vartotojų smalsumą, yra pasirengęs pakeisti sveikatos priežiūros pramonę. Ekspertai spėliojo, kad „iWatch“ galės pateikti daugybę medicininių duomenų visiems nuo bėgikų, besidominčių didžiausiais rezultatais, iki greitosios medicinos pagalbos skyriaus darbuotojų, kuriems reikia greitos statistikos pacientų. Nuo širdies susitraukimų dažnio ir hidratacijos statistikos iki gliukozės kiekio diabetikams, „iWatch“ žada naujovių pramonėje.
Panašu, kad „Apple“ labai gerai supranta, kad didžiausia kliūtis patekti į rinką naudojant „iWatch“ medicinos technologiją gali būti Jungtinių Valstijų maisto ir vaistų administracija (FDA). FDA apibrėžia mobiliąsias programas / įrenginius kaip „programinės įrangos programas, veikiančias išmaniuosiuose telefonuose ir kituose mobiliojo ryšio įrenginiuose. Tai taip pat gali būti priedai, prijungiami prie išmaniojo telefono ar kitų mobiliojo ryšio įrenginių, arba priedų ir programinės įrangos derinys. (7) Nes iWatch medicinos technologija gali kelti pavojų žmonėms, kurie gali ją naudoti, todėl FDA gali tekti peržiūrėti visas iWatch medicinos programas prieš paleisti.
Turinys
- Santykių puoselėjimas
-
Laukimo žaidimas
- Susiję įrašai:
Santykių puoselėjimas
Tikėtina, kad „Apple“ jau kurį laiką stebėjo šią kliūtį. Tiesą sakant, „Apple“ vadovai susitiko su FDA pareigūnais netrukus po to, kai 2010 m. balandžio mėn. buvo pristatytas pirmasis „iPad“.
„Apple“ vadovai žinojo, kad medicinos pramonėje yra didžiulis iPad potencialas. Nuo pat „iPad“ pasirodymo medicinos specialistai priėmė „iPad“, o 2010 m. liepos mėn. „Apple App Store“ buvo apgyvendinta daugiau nei 2 000 medicinos programų. (3)
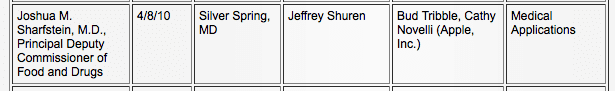
Augant iPad, kaip medicinos pramonės žaidėjo, potencialui, Apple plėtojo ryšius su FDA. Remiantis viešaisiais FDA įrašais, „Apple“ ir FDA susitiko tris kartus, pirmą kartą 2010 m. balandžio 8 d. pasikalbėti apie „medicinos taikymą“ (5) ir dar kartą 2010 m. birželio 11 d. „medicinos prietaisų“ tema. (6)

FDA užduotis yra suderinti visuomenės saugumą ir visuomenės interesus. Po šių dviejų susitikimų 2011 m. liepos mėn. FDA paskelbė pirmąją mobiliųjų medicinos programų apibrėžimų ir gairių kartojimą. (8) Iki 2011 m. rugsėjo mėn. „Apple“ savo „App Store“ (4) paskelbė skyrių „Programos sveikatos priežiūros specialistams“ su sveikatos priežiūros tema. informacinės ir švietimo programos, taip pat pažangesnės programos, įskaitant elektroninius medicininius įrašus (EMR), pacientų stebėjimą ir vaizdavimas.
Laukimo žaidimas
„Apple“ vadovai grįžo į FDA 2013 m. gruodžio mėn., kad aptartų „mobiliąsias medicinos programas“ – tai aiškus požymis. kad „Apple“ pakankamai perėjo į sveikatos stebėjimo technologijų areną, kad žinotų, jog jiems reikia pasikalbėti su FDA adresu ilgio.

FDA tobulino savo apibrėžimus ir politiką, susijusią su medicinos programomis ir prietaisais. „Kai kurios mobiliosios programėlės kelia minimalų pavojų vartotojams ar pacientams, tačiau kitos gali kelti didelę riziką, jei jos neveikia teisingai“, – teigiama neseniai FDA pranešime spaudai ir priduriama: „FDA pritaikyta politika apsaugo pacientus ir skatina naujovės“. (2)
Pranešimas spaudai tęsėsi:
FDA savo priežiūrą sutelkia į mobiliąsias medicinos programas, kurios:
- yra skirti naudoti kaip reguliuojamo medicinos prietaiso priedas, pavyzdžiui, programa, leidžianti sveikatos priežiūros specialistui nustatykite konkrečią diagnozę peržiūrėdami medicininį vaizdą iš nuotraukų archyvavimo ir ryšių sistemos (PACS) išmaniajame telefone arba mobiliajame telefone tablėtė; arba
- paverskite mobiliąją platformą reguliuojamu medicinos prietaisu – pavyzdžiui, programa, kuri paverčia išmanųjį telefoną į elektrokardiografijos (EKG) aparatas, skirtas aptikti nenormalų širdies ritmą arba nustatyti, ar pacientas patiria širdies priepuolį. (2)
Žinoma, kai kurios funkcijos, kurių, kaip gandai, siekia „iWatch“, patenka į FDA priežiūrą. medicinos mobiliesiems įrenginiams ir programėlėms taikomų gairių, „Apple“ taikant tokią pat FDA priežiūrą kaip ir kitiems gamintojų.
Kaip FDA taisyklės, peržiūra, patvirtinimai ir procesai paveiktų medicininės „Apple iWatch“ versijos išleidimą? Paimkime „Smart Body Analyzer“ – „Withings“ gaminį, kuris matuoja svorį, kūno riebalų procentą ir širdies ritmą bei sinchronizuoja su išmaniaisiais telefonais ir „iPad“. Withingsas laukė beveik trejus metus, kol gavo FDA leidimą pradėti veiklą.(1) Sudėtingesnės „Apple“ funkcijos gali reikšti ilgesnį laiką. FDA patvirtinimo laikas, bet galbūt susitikus su FDA kūrimo etapuose, „Apple“ nusipirks šiek tiek laiko. turgus.

Technologijų apsėstas nuo ankstyvo A/UX pasirodymo Apple sistemoje, Sudz (SK) yra atsakingas už AppleToolBox redakcinę kryptį. Jis įsikūręs Los Andžele, Kalifornijoje.
Sudz specializuojasi aprėpdama visus „macOS“ dalykus, per daugelį metų peržiūrėjusi daugybę OS X ir „macOS“ patobulinimų.
Ankstesniame gyvenime Sudzas dirbo padėdamas „Fortune 100“ įmonėms įgyvendinti technologijų ir verslo pertvarkos siekius.