Conforme a Apple, supostamente, vai ao mercado com o iWatch, eles também estão se reunindo com o FDA, apoiando os rumores do potencial médico avançado do iWatch.
O iWatch da Apple, atualmente objeto de rumores da indústria e da curiosidade do consumidor, está prestes a transformar o setor de saúde. Especialistas especularam que o iWatch será capaz de fornecer uma ampla gama de dados médicos para todos desde corredores interessados no desempenho máximo até equipes de emergência que precisam de estatísticas rápidas para tratar pacientes. De estatísticas de frequência cardíaca e hidratação a níveis de glicose para diabéticos, o iWatch promete inovar o setor.
A Apple parece entender muito bem que seu maior obstáculo para chegar ao mercado com a tecnologia médica do iWatch pode ser a Food and Drug Administration (FDA) dos Estados Unidos. O FDA define aplicativos / dispositivos móveis como “programas de software executados em smartphones e outros dispositivos de comunicação móvel. Eles também podem ser acessórios que se conectam a um smartphone ou outros dispositivos de comunicação móvel, ou uma combinação de acessórios e software. ” (7) Porque A tecnologia médica do iWatch pode representar um risco potencial para as pessoas que podem usá-lo, o FDA pode precisar revisar quaisquer aplicações médicas do iWatch antes de lançar.
Conteúdo
- Cultivando relacionamentos
-
O jogo de espera
- Postagens relacionadas:
Cultivando relacionamentos
É provável que a Apple esteja de olho neste obstáculo há algum tempo. Na verdade, os executivos da Apple têm se reunido com funcionários da FDA logo após o lançamento do primeiro iPad em abril de 2010.
Os executivos da Apple sabiam que havia um enorme potencial para o iPad na indústria médica. Desde o momento em que o iPad foi lançado, os profissionais médicos adotaram o iPad e, em julho de 2010, mais de 2.000 aplicativos médicos povoavam a App Store da Apple. (3)
À medida que o potencial do iPad como player na indústria médica crescia, a Apple cultivava um relacionamento com o FDA. De acordo com os registros públicos do FDA, a Apple e o FDA se reuniram três vezes, primeiro em 8 de abril de 2010, para falar sobre “aplicações médicas” (5) e novamente em 11 de junho de 2010, sobre o tema “dispositivos médicos”. (6)

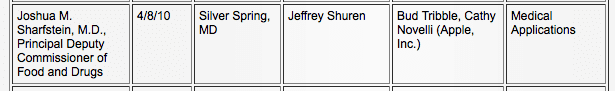
O trabalho do FDA é equilibrar a segurança pública com o interesse público. Após essas duas reuniões, em julho de 2011, o FDA lançou sua primeira iteração de definições e diretrizes para aplicações médicas móveis. (8) Em setembro de 2011, a Apple lançou uma seção chamada “Apps para profissionais de saúde” em sua App Store (4) com o tema saúde aplicativos para referência e educação, bem como aplicativos mais avançados, incluindo registros médicos eletrônicos (EMR), monitoramento de pacientes e imagem.
O jogo de espera
Os executivos da Apple voltaram ao FDA em dezembro de 2013 para discutir "aplicativos médicos móveis", uma indicação clara que a Apple mudou para a arena da tecnologia de monitoramento de saúde o suficiente para saber que eles precisam falar com o FDA em comprimento.

O FDA vem refinando suas definições e políticas relacionadas a aplicativos e dispositivos médicos. “Alguns aplicativos móveis apresentam riscos mínimos para os consumidores ou pacientes, mas outros podem apresentar um risco significativo se não funcionarem corretamente ”, declarou um comunicado à imprensa recente da FDA, acrescentando:“ A política personalizada da FDA protege os pacientes ao mesmo tempo que incentiva inovação." (2)
O comunicado à imprensa continuou:
O FDA está concentrando sua supervisão em aplicativos médicos móveis que:
- destinam-se a ser usados como um acessório para um dispositivo médico regulamentado - por exemplo, um aplicativo que permite a um profissional de saúde faça um diagnóstico específico visualizando uma imagem médica a partir de um sistema de comunicação e arquivamento de imagens (PACS) em um smartphone ou celular tábua; ou
- transformar uma plataforma móvel em um dispositivo médico regulamentado - por exemplo, um aplicativo que transforma um smartphone em um máquina de eletrocardiografia (ECG) para detectar ritmos cardíacos anormais ou determinar se um paciente está tendo um ataque cardíaco. ” (2)
Certamente, algumas das funcionalidades que o iWatch supostamente aspiram cai sob a supervisão do FDA diretrizes para dispositivos médicos móveis e aplicativos, sujeitando a Apple ao mesmo escrutínio do FDA que outros fabricantes.
Como os regulamentos, análises, aprovações e processos da FDA impactariam o lançamento de uma versão médica do iWatch da Apple? Veja o caso do Smart Body Analyzer, um produto da Withings que mede peso, percentual de gordura corporal e frequência cardíaca, e sincroniza com smartphones e iPads. Withings esperou por quase três anos para obter autorização do FDA para o lançamento. (1) A funcionalidade mais sofisticada da Apple pode significar um tempo de aprovação pelo FDA, mas talvez reunindo-se com o FDA nos estágios de desenvolvimento, a Apple terá ganhado algum tempo enquanto vai para mercado.

Obcecado por tecnologia desde a chegada antecipada do A / UX na Apple, Sudz (SK) é responsável pela direção editorial do AppleToolBox. Ele mora em Los Angeles, CA.
Sudz é especialista em cobrir todas as coisas do macOS, tendo revisado dezenas de desenvolvimentos do OS X e do macOS ao longo dos anos.
Em uma vida anterior, Sudz trabalhou ajudando empresas da Fortune 100 com suas aspirações de tecnologia e transformação de negócios.