Als Apple angeblich mit iWatch auf den Markt kommt, treffen sie sich auch mit der FDA, um Gerüchte über das fortschrittliche medizinische Potenzial von iWatch zu unterstützen.
Die iWatch von Apple, die derzeit Gegenstand von Branchengerüchten und der Neugier der Verbraucher ist, steht kurz davor, die Gesundheitsbranche zu verändern. Experten haben spekuliert, dass die iWatch in der Lage sein wird, eine breite Palette medizinischer Daten für jeden bereitzustellen von Läufern, die an Höchstleistungen interessiert sind, bis hin zu Mitarbeitern in der Notaufnahme, die schnelle Statistiken zur Behandlung benötigen Patienten. Von Herzfrequenz- und Flüssigkeitsstatistiken bis hin zu Blutzuckerwerten für Diabetiker verspricht die iWatch Innovationen in der Branche.
Apple scheint sehr gut zu verstehen, dass die größte Hürde bei der Markteinführung mit der Medizintechnik von iWatch die US-amerikanische Food and Drug Administration (FDA) sein könnte. Die FDA definiert mobile Apps/Geräte als „Softwareprogramme, die auf Smartphones und anderen mobilen Kommunikationsgeräten ausgeführt werden. Sie können auch Zubehör sein, das an einem Smartphone oder anderen mobilen Kommunikationsgeräten befestigt wird, oder eine Kombination aus Zubehör und Software.“ (7) Weil Die Medizintechnik von iWatch könnte potenziell ein Risiko für die Benutzer darstellen, die FDA muss möglicherweise alle medizinischen Anwendungen von iWatch überprüfen, bevor Start.
Inhalt
- Beziehungen pflegen
-
Das Wartespiel
- Zusammenhängende Posts:
Beziehungen pflegen
Vermutlich hat Apple diese Hürde schon länger im Blick. Tatsächlich treffen sich Apple-Führungskräfte seit kurz nach der Markteinführung des ersten iPad im April 2010 mit FDA-Beamten.
Apple-Führungskräfte wussten, dass das iPad in der Medizinbranche ein enormes Potenzial hat. Von dem Moment an, als das iPad auf den Markt kam, nahmen Mediziner das iPad an und bis Juli 2010 füllten mehr als 2.000 medizinische Apps den App Store von Apple. (3)
Als das Potenzial für das iPad als Akteur in der Medizinbranche zunahm, baute Apple eine Beziehung zur FDA auf. Laut den öffentlichen Aufzeichnungen der FDA haben sich Apple und die FDA dreimal getroffen, zuerst am 8. April 2010. zum Thema „Medizinische Anwendungen“ (5) und am 11. Juni 2010 erneut zum Thema „Medizinprodukte“. (6)

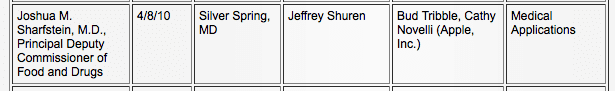
Die Aufgabe der FDA besteht darin, die öffentliche Sicherheit mit dem öffentlichen Interesse in Einklang zu bringen. Nach diesen beiden Sitzungen veröffentlichte die FDA im Juli 2011 ihre erste Iteration von Definitionen und Richtlinien für mobile medizinische Anwendungen. (8) Bis September 2011 führte Apple in seinem App Store (4) einen Abschnitt namens „Apps für medizinisches Fachpersonal“ mit Gesundheitsthemen ein Apps zu Referenz- und Schulungszwecken sowie fortschrittlichere Apps, einschließlich elektronischer Krankenakten (EMR), Patientenüberwachung und Bildgebung.
Das Wartespiel
Apple-Führungskräfte waren im Dezember 2013 wieder bei der FDA, um über „mobile medizinische Anwendungen“ zu diskutieren, ein klarer Hinweis dass Apple in die Arena der Gesundheitsüberwachungstechnologie eingestiegen ist, um zu wissen, dass sie mit der FDA sprechen müssen Länge.

Die FDA hat ihre Definitionen und Richtlinien zu medizinischen Anwendungen und Geräten verfeinert. „Einige mobile Apps bergen minimale Risiken für Verbraucher oder Patienten, andere können jedoch ein erhebliches Risiko bergen, wenn sie nicht funktionieren. richtig“, heißt es in einer kürzlich veröffentlichten Pressemitteilung der FDA und fügt hinzu: „Die maßgeschneiderte Richtlinie der FDA schützt Patienten und fördert gleichzeitig die Innovation." (2)
Weiter ging es in der Pressemitteilung:
Die FDA konzentriert ihre Aufsicht auf mobile medizinische Apps, die:
- als Zubehör zu einem regulierten Medizinprodukt verwendet werden sollen – zum Beispiel eine Anwendung, die es einem medizinischen Fachpersonal ermöglicht, eine spezifische Diagnose erstellen, indem Sie ein medizinisches Bild von einem Bildarchivierungs- und Kommunikationssystem (PACS) auf einem Smartphone oder Mobiltelefon anzeigen Tablette; oder
- verwandeln eine mobile Plattform in ein reguliertes Medizinprodukt – zum Beispiel eine Anwendung, die aus einem Smartphone ein Elektrokardiographiegerät (EKG), um Herzrhythmusstörungen zu erkennen oder festzustellen, ob ein Patient einen Herzinfarkt erleidet.“ (2)
Sicherlich fallen einige der Funktionen, die iWatch angeblich anstreben soll, unter die Aufsicht der FDA Richtlinien für medizinische Mobilgeräte und Apps, die Apple der gleichen FDA-Prüfung unterziehen wie andere Hersteller.
Wie würden sich die Vorschriften, Überprüfungen, Zulassungen und Prozesse der FDA auf die Veröffentlichung einer medizinischen Version der iWatch von Apple auswirken? Nehmen Sie den Smart Body Analyzer, ein Produkt von Withings, das Gewicht, Körperfettanteil und Herzfrequenz misst und mit Smartphones und iPads synchronisiert. Withings wartete fast drei Jahre, um die FDA-Zulassung für die Markteinführung zu erhalten. (1) Die ausgefeiltere Funktionalität von Apple könnte eine längere Zeit bedeuten Zulassungszeit durch die FDA, aber vielleicht hat Apple durch ein Treffen mit der FDA in der Entwicklungsphase etwas Zeit gewonnen Markt.

Sudz (SK) ist seit der frühen Einführung von A/UX bei Apple von Technik besessen und für die redaktionelle Leitung von AppleToolBox verantwortlich. Er hat seinen Sitz in Los Angeles, Kalifornien.
Sudz ist darauf spezialisiert, alles rund um macOS abzudecken und hat im Laufe der Jahre Dutzende von OS X- und macOS-Entwicklungen überprüft.
In einem früheren Leben half Sudz Fortune-100-Unternehmen bei ihren Bestrebungen zur Technologie- und Geschäftstransformation.