Kun Applen kerrotaan tulevan markkinoille iWatchin kanssa, he tapaavat myös FDA: n ja tukevat huhuja iWatchin edistyneestä lääketieteellisestä potentiaalista.
Applen iWatch, joka on tällä hetkellä alan huhujen ja kuluttajien uteliaisuuden aiheena, on valmis muuttamaan terveydenhuoltoalaa. Asiantuntijat ovat spekuloineet, että iWatch pystyy tarjoamaan laajan valikoiman lääketieteellisiä tietoja kaikille huippusuorituskyvystä kiinnostuneista juoksijoista päivystyshenkilökuntaan, joka tarvitsee nopeaa hoitoa potilaita. Syke- ja nesteytystilastoista diabeetikkojen glukoositasoihin iWatch lupaa innovoida alaa.
Apple näyttää ymmärtävän erittäin hyvin, että heidän suurin este iWatchin lääketieteellisen teknologian markkinoille pääsemiselle voisi olla Yhdysvaltain elintarvike- ja lääkevirasto (FDA). FDA määrittelee mobiilisovellukset/laitteet "ohjelmistoohjelmiksi, jotka toimivat älypuhelimissa ja muissa matkaviestinlaitteissa. Ne voivat olla myös älypuhelimeen tai muihin matkaviestinlaitteisiin liitettäviä lisävarusteita tai lisävarusteiden ja ohjelmistojen yhdistelmää. (7) Koska iWatch-lääketieteellinen teknologia voi mahdollisesti aiheuttaa riskin ihmisille, jotka saattavat käyttää sitä, FDA saattaa joutua tarkistamaan kaikki iWatchin lääketieteelliset sovellukset ennen tuoda markkinoille.
Sisällys
- Suhteiden kehittäminen
-
Odottava peli
- Aiheeseen liittyvät julkaisut:
Suhteiden kehittäminen
On todennäköistä, että Apple on nähnyt tämän esteen jo jonkin aikaa. Itse asiassa Applen johtajat ovat tavanneet FDA: n viranomaisia pian ensimmäisen iPadin julkaisun jälkeen huhtikuussa 2010.
Applen johtajat tiesivät, että iPadilla oli valtava potentiaali lääketeollisuudessa. iPadin julkaisusta lähtien lääketieteen ammattilaiset omaksuivat iPadin, ja heinäkuuhun 2010 mennessä Applen App Storessa oli yli 2 000 lääketieteellistä sovellusta. (3)
Kun iPadin potentiaali lääketeollisuuden toimijana kasvoi, Apple kehitti suhdetta FDA: han. FDA: n julkisten asiakirjojen mukaan Apple ja FDA ovat tavanneet kolme kertaa, ensin 8. huhtikuuta 2010, puhua "lääketieteellisistä sovelluksista" (5) ja uudelleen 11. kesäkuuta 2010 aiheesta "lääketieteelliset laitteet". (6)

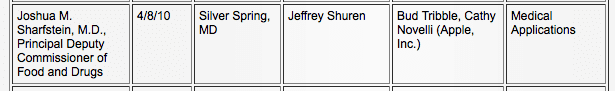
FDA: n tehtävänä on tasapainottaa yleinen turvallisuus ja yleinen etu. Näiden kahden kokouksen jälkeen, heinäkuussa 2011, FDA julkaisi ensimmäisen iteraationsa määritelmistä ja ohjeista Mobile Medical Applicationsille. (8) Syyskuuhun 2011 mennessä Apple julkaisi App Storessa (4) terveydenhuoltoaiheisen osion nimeltä "Apps for Healthcare Professionals" sovelluksia viitteellisiin ja koulutustarkoituksiin sekä edistyneempiä sovelluksia, mukaan lukien sähköiset sairaustiedot (EMR), potilaan seuranta ja kuvantaminen.
Odottava peli
Applen johtajat palasivat FDA: hun joulukuussa 2013 keskustelemaan "mobiililääketieteellisistä sovelluksista", mikä on selkeä osoitus että Apple on siirtynyt terveyden seurantateknologian areenalle tarpeeksi tietääkseen, että heidän on keskusteltava FDA: n kanssa osoitteessa pituus.

FDA on tarkentanut lääketieteellisiin sovelluksiin ja laitteisiin liittyviä määritelmiä ja käytäntöjä. "Jotkut mobiilisovellukset aiheuttavat minimaalisia riskejä kuluttajille tai potilaille, mutta toiset voivat sisältää merkittäviä riskejä, jos ne eivät toimi oikein", totesi äskettäinen FDA: n lehdistötiedote ja lisäsi: "FDA: n räätälöity politiikka suojelee potilaita ja rohkaisee innovaatio." (2)
Lehdistötiedote jatkui:
FDA keskittyy valvontansa mobiilisovelluksiin, jotka:
- on tarkoitettu käytettäväksi säännellyn lääkinnällisen laitteen lisävarusteena – esimerkiksi sovelluksena, jonka avulla terveydenhuollon ammattilainen voi tee tietty diagnoosi katsomalla lääketieteellistä kuvaa kuvien arkistointi- ja viestintäjärjestelmästä (PACS) älypuhelimella tai matkapuhelimella tabletti; tai
- muuntaa mobiilialustan säädellyksi lääketieteelliseksi laitteeksi – esimerkiksi sovellukseksi, joka muuttaa älypuhelimen laitteeksi elektrokardiografia (EKG) tunnistaa epänormaalit sydämen rytmit tai määrittää, onko potilaalla sydänkohtaus." (2)
Varmasti osa toiminnoista, joihin iWatchin huhutaan pyrkivän, kuuluu FDA: n valvonnan piiriin. lääketieteellisille mobiililaitteille ja -sovelluksille tarkoitettuja ohjeita, jolloin Apple on saman FDA: n valvonnan alainen kuin muutkin valmistajat.
Miten FDA: n määräykset, arvostelut, hyväksynnät ja prosessit vaikuttaisivat Applen iWatchin lääketieteellisen version julkaisuun? Otetaan esimerkiksi Smart Body Analyzer, Withingsin tuote, joka mittaa painon, kehon rasvaprosentin ja sykkeen sekä synkronoi älypuhelimien ja iPadien kanssa. Withings odotti lähes kolme vuotta saadakseen FDA-luvan markkinoille.(1) Applen kehittyneempi toiminnallisuus voi tarkoittaa pidempään FDA: n hyväksymisaika, mutta ehkä tapaamalla FDA: n kanssa kehitysvaiheessa Apple on ostanut jonkin aikaa markkinoida.

Sudz (SK) on ollut tekniikan pakkomielle sen jälkeen, kun A/UX ilmestyi Applelle, ja hän on vastuussa AppleToolBoxin toimituksellisesta suunnasta. Hänen kotipaikkansa on Los Angeles, Kalifornia.
Sudz on erikoistunut kattamaan kaiken macOS: n, koska hän on vuosien varrella arvioinut kymmeniä OS X- ja macOS-kehityksiä.
Aikaisemmassa elämässään Sudz työskenteli auttamalla Fortune 100 -yrityksiä niiden teknologia- ja liiketoimintamuutospyrkimyksissä.