Alors qu'Apple serait sur le marché avec iWatch, ils rencontrent également la FDA, soutenant les rumeurs sur le potentiel médical avancé d'iWatch.
L'iWatch d'Apple, actuellement l'objet de rumeurs dans l'industrie et de la curiosité des consommateurs, est sur le point de transformer le secteur de la santé. Les experts ont émis l'hypothèse que l'iWatch serait en mesure de fournir un large éventail de données médicales pour tout le monde des coureurs intéressés par des performances de pointe au personnel des urgences qui ont besoin de statistiques rapides pour traiter les patients. Des statistiques de fréquence cardiaque et d'hydratation aux niveaux de glucose pour les diabétiques, l'iWatch promet d'innover dans l'industrie.
Apple semble très bien comprendre que le principal obstacle à la commercialisation de la technologie médicale d'iWatch pourrait être la Food and Drug Administration (FDA) des États-Unis. La FDA définit les applications/appareils mobiles comme des « programmes logiciels qui s'exécutent sur les smartphones et autres appareils de communication mobiles. Il peut également s'agir d'accessoires qui se fixent à un smartphone ou à d'autres appareils de communication mobiles, ou une combinaison d'accessoires et de logiciels. (7) Parce que La technologie médicale iWatch pourrait potentiellement présenter un risque pour les personnes qui pourraient l'utiliser, la FDA peut avoir besoin d'examiner toutes les applications médicales iWatch avant de lancement.
Contenu
- Cultiver des relations
-
Le jeu de l'attente
- Articles Similaires:
Cultiver des relations
Il est probable qu'Apple ait l'œil sur cet obstacle depuis un certain temps. En fait, les dirigeants d'Apple ont rencontré les responsables de la FDA peu après le lancement en avril 2010 du premier iPad.
Les dirigeants d'Apple savaient qu'il y avait un énorme potentiel pour l'iPad dans l'industrie médicale. Dès le lancement de l'iPad, les professionnels de la santé ont adopté l'iPad et, en juillet 2010, plus de 2 000 applications médicales remplissaient l'App Store d'Apple. (3)
Alors que le potentiel de l'iPad en tant qu'acteur dans l'industrie médicale augmentait, Apple entretenait une relation avec la FDA. Selon les archives publiques de la FDA, Apple et la FDA se sont rencontrés trois fois, d'abord le 8 avril 2010, pour parler des « applications médicales » (5) et encore le 11 juin 2010, sur le thème des « dispositifs médicaux ». (6)

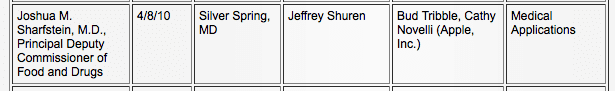
Le travail de la FDA consiste à équilibrer la sécurité publique avec l'intérêt public. Après ces deux réunions, en juillet 2011, la FDA a publié sa première itération de définitions et de lignes directrices pour les applications médicales mobiles. (8) En septembre 2011, Apple a lancé une section intitulée « Apps pour les professionnels de la santé » dans son App Store (4) avec des thèmes sur les soins de santé. applications de référence et d'éducation ainsi que des applications plus avancées, y compris les dossiers médicaux électroniques (DME), la surveillance des patients et imagerie.
Le jeu de l'attente
Les dirigeants d'Apple étaient de retour à la FDA en décembre 2013 pour discuter des « applications médicales mobiles », une indication claire qu'Apple est suffisamment entré dans le domaine de la technologie de surveillance de la santé pour savoir qu'ils doivent parler avec la FDA au longueur.

La FDA a affiné ses définitions et politiques concernant les applications et dispositifs médicaux. « Certaines applications mobiles comportent des risques minimes pour les consommateurs ou les patients, mais d'autres peuvent comporter des risques importants si elles ne fonctionnent pas. correctement », a déclaré un récent communiqué de presse de la FDA, ajoutant: « La politique sur mesure de la FDA protège les patients tout en encourageant innovation." (2)
Le communiqué de presse continuait :
La FDA concentre sa surveillance sur les applications médicales mobiles qui :
- sont destinés à être utilisés comme accessoire d'un dispositif médical réglementé - par exemple, une application qui permet à un professionnel de la santé de poser un diagnostic précis en visualisant une image médicale issue d'un système d'archivage et de communication d'images (PACS) sur un smartphone ou un mobile tablette; ou
- transformer une plate-forme mobile en un dispositif médical réglementé - par exemple, une application qui transforme un smartphone en un appareil d'électrocardiographie (ECG) pour détecter des rythmes cardiaques anormaux ou déterminer si un patient subit une crise cardiaque. (2)
Certes, certaines des fonctionnalités auxquelles iWatch aspirerait relèvent de la surveillance de la FDA. directives pour les appareils et applications mobiles médicaux, soumettant Apple au même examen de la FDA que les autres fabricants.
Quel serait l'impact des réglementations, des examens, des approbations et des processus de la FDA sur la sortie d'une version médicale de l'iWatch d'Apple? Prenons le cas du Smart Body Analyzer, un produit de Withings qui mesure le poids, le pourcentage de graisse corporelle et la fréquence cardiaque, et qui se synchronise avec les smartphones et les iPad. Withings a attendu près de trois ans pour obtenir l'autorisation de lancement de la FDA. (1) La fonctionnalité plus sophistiquée d'Apple pourrait signifier un plus long délai d'approbation par la FDA, mais peut-être qu'en rencontrant la FDA au cours des étapes de développement, Apple aura gagné du temps pour marché.

Obsédé par la technologie depuis l'arrivée précoce d'A/UX sur Apple, Sudz (SK) est responsable de la direction éditoriale d'AppleToolBox. Il est basé à Los Angeles, en Californie.
Sudz est spécialisé dans la couverture de tout ce qui concerne macOS, après avoir examiné des dizaines de développements OS X et macOS au fil des ans.
Dans une vie antérieure, Sudz a travaillé à aider les entreprises Fortune 100 dans leurs aspirations de transformation technologique et commerciale.